本文深入探讨了金属活动性顺序表中还原性强弱的奥秘,通过对不同金属在化学反应中的表现进行分析,揭示了其背后的本质原因,金属的还原性与其原子结构密切相关,原子半径、核电荷数等因素都会影响金属失去电子的能力,在顺序表中,越靠前的金属还原性越强,越容易与其他物质发生反应,这一规律不仅在化学实验中有重要应用,也对理解金属的性质和用途具有关键意义,研究金属活动性顺序表还能帮助我们预测化学反应的方向和程度,为材料科学、环境保护等领域提供理论支持。
在化学的广阔领域中,金属活动性顺序表是一个至关重要的工具,它清晰地展示了各种金属在化学反应中的活泼程度以及还原性的相对强弱,深入研究金属活动性顺序表中还原性强弱的规律,不仅有助于我们更好地理解化学反应的本质,还能为众多实际应用提供坚实的理论基础。
金属活动性顺序表通常按照金属元素在水溶液中失去电子的难易程度进行排列,从左到右金属的还原性逐渐减弱,这个顺序表涵盖了众多常见的金属元素,如钾(K)、钙(Ca)、钠(Na)、镁(Mg)、铝(Al)、锌(Zn)、铁(Fe)、锡(Sn)、铅(Pb)、氢(H)、铜(Cu)、汞(Hg)、银(Ag)、铂(Pt)、金(Au)等。
让我们首先从最活泼的金属钾开始探索,钾原子的最外层电子数较少,只有一个电子,它在化学反应中非常容易失去这个电子,从而表现出很强的还原性,当钾与水接触时,会迅速发生剧烈反应,生成氢氧化钾和氢气,这是因为钾原子强烈地渴望失去电子,而水中的氢离子则很容易获得电子,从而形成氢气,这种强烈的反应性使得钾在自然界中通常以化合物的形式存在,而不是游离态。
钙和钠的还原性也很强,它们在化学反应中同样容易失去电子,钙可以与水反应生成氢氧化钙和氢气,钠与水反应则更加剧烈,甚至可能引发爆炸,这些金属的还原性使得它们在冶金工业中具有重要的应用价值,例如用于提炼其他金属。
镁和铝的还原性相对较弱,但仍然比许多金属要强,镁在空气中可以与氧气发生氧化反应,生成氧化镁,而铝则具有良好的抗腐蚀性能,这是因为铝表面会形成一层致密的氧化铝薄膜,阻止了铝的进一步氧化。
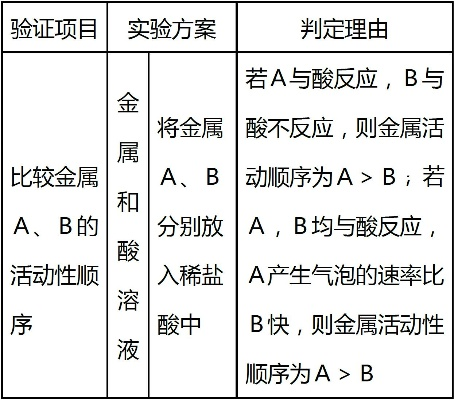
锌、铁、锡、铅等金属的还原性依次减弱,锌可以与酸发生反应,置换出氢气,而铁则需要在较强的条件下才能与酸反应,锡和铅的还原性更弱,它们在常温下通常比较稳定,不易与其他物质发生反应。
氢在金属活动性顺序表中处于一个特殊的位置,它既可以表现出氧化性,也可以表现出还原性,在某些化学反应中,氢可以失去电子,表现出还原性,例如氢气可以与氧气反应生成水,但在另一些化学反应中,氢也可以获得电子,表现出氧化性,例如氢气可以与金属氧化物反应,将金属还原出来。
铜、汞、银、铂、金等金属的还原性非常弱,它们在自然界中通常以游离态存在,并且具有很高的化学稳定性,金几乎不与任何物质发生反应,因此被广泛用于珠宝制造和货币领域。
金属活动性顺序表中还原性强弱的规律是由金属原子的结构和电子排布所决定的,金属原子的最外层电子数越少,电子层数越多,原子半径越大,其还原性就越强,这是因为原子半径越大,原子核对外层电子的吸引力就越小,电子就越容易失去。
在实际应用中,金属活动性顺序表的还原性强弱规律具有重要的意义,在金属的冶炼过程中,我们可以根据金属的还原性强弱选择合适的还原剂,对于还原性较强的金属,如钾、钙、钠等,可以使用电解法进行冶炼;对于还原性较弱的金属,如铜、银、金等,可以使用热还原法进行冶炼,金属活动性顺序表还可以用于判断金属与酸、盐等物质的反应性,以及预测化学反应的方向和产物。
金属活动性顺序表中还原性强弱的规律是化学研究中的一个重要内容,通过深入了解金属的还原性强弱,我们可以更好地理解化学反应的本质,为实际应用提供理论指导,随着科学技术的不断发展,金属活动性顺序表的应用领域也在不断扩大,相信在未来,它将为人类的生活和社会发展做出更大的贡献。






 京公网安备11000000000001号
京公网安备11000000000001号 沪ICP备19017178号-1
沪ICP备19017178号-1
还没有评论,来说两句吧...