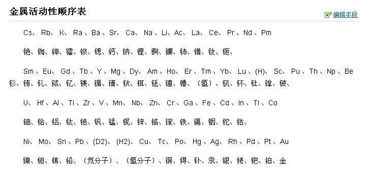
《探秘金属活动性顺序表置换规律》:金属活动性顺序表是化学中的重要工具,它揭示了不同金属在化学反应中的活泼程度差异,通过该顺序表,我们能清晰了解到哪些金属能将其他金属从其化合物溶液中置换出来,排在前面的金属能置换出后面的金属,这一规律在诸多化学实验和实际应用中都有着关键作用,如湿法冶金等,深入探究金属活动性顺序表的置换规律,有助于我们更好地理解金属的化学性质和化学反应原理,为相关领域的研究和实践提供坚实的理论基础。
在化学的奇妙世界里,金属活动性顺序表如同一张指引着化学反应方向的地图,而其中的置换规律则是这张地图上最为关键的坐标之一,它揭示了金属之间在化学反应中相互作用的奥秘,为我们理解和预测无数化学现象提供了重要的理论基础。
金属活动性顺序表是按照金属在水溶液中失去电子的难易程度排列而成的,金属的位置越靠前,其活动性越强,越容易失去电子变成阳离子;而金属的位置越靠后,其活动性越弱,越难失去电子,这个顺序表为我们理解金属之间的置换反应提供了清晰的线索。
置换反应是一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,在金属活动性顺序表中,位于前面的金属能够将位于后面的金属从它们的化合物溶液中置换出来,铁(Fe)能够将铜(Cu)从硫酸铜(CuSO4)溶液中置换出来,生成硫酸亚铁(FeSO4)和铜,这是因为铁的活动性比铜强,铁更容易失去电子,而铜离子(Cu2+)更容易获得电子变成铜原子。
这种置换规律在实际生活中有广泛的应用,在湿法冶金中,人们利用金属活动性顺序表来提取金属,从含有银(Ag)的矿石中提取银,可以将矿石与含有铜的溶液混合,由于铜的活动性比银强,铜会与银离子发生置换反应,将银从矿石中置换出来。
金属活动性顺序表的置换规律也在其他领域有着重要的应用,在电池中,不同金属的活动性差异可以产生电流,锌(Zn)和铜(Cu)组成的电池中,锌的活动性比铜强,锌会失去电子变成锌离子(Zn2+),而铜离子(Cu2+)会在铜电极上获得电子变成铜原子,从而形成电流。
需要注意的是,金属活动性顺序表的置换规律并不是绝对的,在某些情况下,化学反应可能会受到其他因素的影响,例如温度、浓度、催化剂等,金属的活动性也可能会随着环境的变化而发生改变,在实际应用中,我们需要综合考虑各种因素,以确保化学反应能够按照我们的预期进行。
金属活动性顺序表的置换规律是化学中一个非常重要的概念,它为我们理解和预测金属之间的化学反应提供了重要的理论基础,通过了解这个规律,我们可以更好地理解自然界中的化学现象,开发出更加高效的化学工艺和技术,这个规律也提醒我们,在实际应用中需要综合考虑各种因素,以确保化学反应能够按照我们的预期进行。





 京公网安备11000000000001号
京公网安备11000000000001号 沪ICP备19017178号-1
沪ICP备19017178号-1
还没有评论,来说两句吧...