金属活动性顺序表是化学领域中重要的规律总结,它按照金属在水溶液中失去电子的能力强弱进行排列,排在前面的金属活动性强,能将后面的金属从其盐溶液中置换出来,这一顺序表反映了金属的还原性强弱,同时也暗示了其对应离子的氧化性强弱,钾的活动性最强,还原性最强,钾离子氧化性最弱;而金的活动性极弱,还原性极弱,金离子氧化性很强,通过对金属活动性顺序表的理解和运用,我们可以预测化学反应的方向和程度,解释许多金属相关的化学现象,在冶金、电镀等众多领域都有着广泛的应用。
在化学的广袤世界中,金属活动性顺序表犹如一把神奇的钥匙,开启了对物质氧化性和还原性深入理解的大门,它不仅是化学学习中的重要工具,更是揭示化学反应本质和规律的关键所在。
金属活动性顺序表的构建
金属活动性顺序表是按照金属在水溶液中失去电子的难易程度排列而成的,其排列顺序通常为:钾(K)、钙(Ca)、钠(Na)、镁(Mg)、铝(Al)、锌(Zn)、铁(Fe)、锡(Sn)、铅(Pb)、氢(H)、铜(Cu)、汞(Hg)、银(Ag)、铂(Pt)、金(Au),这个顺序反映了金属原子在化学反应中对电子的吸引能力和失去电子的倾向。
氧化性与还原性的基本概念
氧化性是指物质得电子的能力,具有氧化性的物质在化学反应中能够夺取其他物质的电子,使自身被还原,还原性则是指物质失电子的能力,具有还原性的物质在化学反应中容易失去电子,使自身被氧化,氧化性和还原性是相互对立又相互依存的关系,它们共同构成了化学反应的动力和方向。
金属活动性顺序表与氧化性、还原性的关系
-
金属的还原性 在金属活动性顺序表中,金属的位置越靠前,其还原性越强,这意味着位于顺序表前面的金属更容易失去电子,成为阳离子,而位于顺序表后面的金属则相对较难失去电子,钾(K)是最活泼的金属之一,它在水溶液中能够非常容易地失去一个电子,形成钾离子(K+),而金(Au)则是一种非常不活泼的金属,它几乎不与其他物质发生化学反应,因为它很难失去电子。
-
金属离子的氧化性 金属离子的氧化性与其对应的金属的还原性相反,在金属活动性顺序表中,金属离子的氧化性越强,其对应的金属的还原性就越弱,铜离子(Cu2+)的氧化性比铁离子(Fe3+)强,这意味着铜离子更容易得到电子,而铁离子则相对较难得到电子。
-
非金属的氧化性 在金属活动性顺序表中,非金属的位置越靠后,其氧化性越强,这意味着位于顺序表后面的非金属更容易得到电子,成为阴离子,而位于顺序表前面的非金属则相对较难得到电子,氟(F)是最活泼的非金属之一,它在水溶液中能够非常容易地得到一个电子,形成氟离子(F-),而氧(O)则是一种比较活泼的非金属,它在化学反应中也能够比较容易地得到电子。
金属活动性顺序表在化学反应中的应用
-
判断金属与酸的反应 在金属活动性顺序表中,位于氢前面的金属能够与酸发生置换反应,生成盐和氢气,锌(Zn)能够与盐酸(HCl)发生反应,生成氯化锌(ZnCl2)和氢气(H2),而位于氢后面的金属则不能与酸发生置换反应。
-
判断金属与盐溶液的反应 在金属活动性顺序表中,位于前面的金属能够将位于后面的金属从其盐溶液中置换出来,铁(Fe)能够将硫酸铜(CuSO4)溶液中的铜置换出来,生成硫酸亚铁(FeSO4)和铜(Cu)。
-
比较金属的还原性强弱 通过金属活动性顺序表,可以比较不同金属的还原性强弱,钾(K)的还原性比钠(Na)强,因为钾在金属活动性顺序表中的位置比钠更靠前。
-
预测化学反应的方向 根据金属活动性顺序表,可以预测化学反应的方向,在一个含有多种金属离子的溶液中,如果加入一种比溶液中金属离子还原性更强的金属,那么该金属就会与溶液中的金属离子发生置换反应,生成相应的金属和盐。
金属活动性顺序表的局限性
虽然金属活动性顺序表在化学学习和研究中具有重要的作用,但它也存在一定的局限性,金属活动性顺序表是在水溶液中得出的,对于在非水溶液或高温等特殊条件下的金属化学反应,其适用性可能会受到一定的影响,金属活动性顺序表只是一个相对的规律,对于一些特殊的金属或化合物,其氧化性和还原性可能会与金属活动性顺序表的预测结果有所不同。
金属活动性顺序表是化学中一个非常重要的工具,它通过对金属在水溶液中失去电子的难易程度的排列,揭示了金属的氧化性和还原性规律,通过金属活动性顺序表,我们可以判断金属与酸、盐溶液的反应,比较金属的还原性强弱,预测化学反应的方向等,我们也应该认识到金属活动性顺序表的局限性,在实际应用中需要结合具体情况进行分析和判断,金属活动性顺序表是化学学习和研究中不可或缺的一部分,它为我们理解化学反应的本质和规律提供了重要的依据。

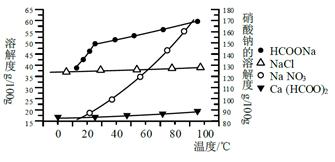





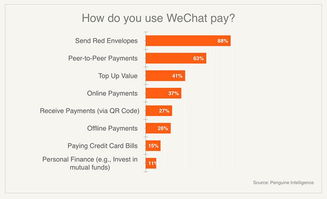
 京公网安备11000000000001号
京公网安备11000000000001号 沪ICP备19017178号-1
沪ICP备19017178号-1
发表评论