金属活动性顺序表是化学中重要的规律总结,它将常见金属按照活动性强弱依次排列,氢前金属能与酸发生置换反应产生氢气,而氢后金属则不能,这背后反映出金属原子得失电子的能力差异,氢前金属具有较强的还原性,易失去电子;氢后金属还原性较弱,这种顺序在判断金属间的置换反应能否发生、金属的冶炼方法选择等方面都有着关键作用,是理解许多化学现象和反应的基础,对于深入研究化学性质和变化具有重要意义。
在化学的广阔领域中,金属活动性顺序表是一个至关重要的工具,它清晰地揭示了各种金属在化学反应中的活泼程度差异,氢作为一个特殊的参考元素,将金属分为氢前和氢后两类,这一分类不仅仅是简单的划分,更蕴含着深刻的化学原理和广泛的应用价值,本文将深入探讨金属活动性顺序表中氢前和氢后的奥秘,带领读者领略化学世界的奇妙之处。
金属活动性顺序表的基本内容
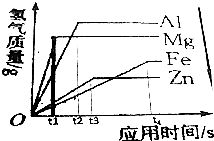
金属活动性顺序表是按照金属在水溶液中失去电子的能力强弱排列而成的,金属的位置越靠前,其活动性越强,即越容易失去电子发生氧化反应,氢前金属能够与酸发生置换反应,生成氢气和相应的盐;而氢后金属则不能与酸发生此类反应,锌(Zn)位于氢前,能与盐酸(HCl)反应生成氯化锌(ZnCl₂)和氢气(H₂):Zn + 2HCl = ZnCl₂ + H₂↑;而铜(Cu)位于氢后,就不能与盐酸发生反应。
氢前金属的特点及反应
- 与酸的反应
- 氢前金属与酸反应的本质是金属单质将酸中的氢置换出来,以镁(Mg)与稀硫酸(H₂SO₄)反应为例,反应方程式为:Mg + H₂SO₄ = MgSO₄ + H₂↑,在这个反应中,镁原子失去电子变成镁离子(Mg²⁺),氢离子(H⁺)得到电子变成氢气分子(H₂),这种反应的剧烈程度随着金属活动性的增强而增加,镁与稀硫酸反应比铁(Fe)与稀硫酸反应更加剧烈,因为镁的活动性比铁强。
- 氢前金属与酸反应的速率还受到酸的浓度、温度等因素的影响,酸的浓度越高、温度越高,反应速率越快。
- 与盐溶液的反应
- 氢前金属还能与一些盐溶液发生置换反应,铁与硫酸铜(CuSO₄)溶液反应,会生成铜和硫酸亚铁(FeSO₄):Fe + CuSO₄ = Cu + FeSO₄,在这个反应中,铁将硫酸铜中的铜置换出来,这是因为铁的活动性比铜强,这种反应也体现了金属活动性顺序表在判断置换反应能否发生方面的重要作用。
- 氢前金属与盐溶液的反应也遵循一定的规律,即活动性较强的金属可以置换出活动性较弱的金属的盐溶液中的金属。
氢后金属的特性及反应
- 与酸的反应
氢后金属不能与酸发生置换反应生成氢气,铜、银(Ag)等氢后金属与盐酸、稀硫酸等常见酸都不反应,这是因为它们在金属活动性顺序表中的位置决定了它们失去电子的能力较弱,无法从酸中夺取氢离子。
- 与盐溶液的反应
氢后金属在一定条件下也能与某些盐溶液发生反应,但与氢前金属的反应有所不同,铜可以与硝酸银(AgNO₃)溶液反应生成银和硝酸铜(Cu(NO₃)₂):Cu + 2AgNO₃ = 2Ag + Cu(NO₃)₂,在这个反应中,铜将硝酸银中的银置换出来,但反应的原理与氢前金属与盐溶液的反应有所区别,氢后金属与盐溶液的反应通常是氧化还原反应,涉及到更复杂的电子转移过程。
金属活动性顺序表的应用
- 金属的冶炼
根据金属活动性顺序表,我们可以选择合适的方法来冶炼金属,对于氢前金属,如铁、锌等,通常采用热还原法进行冶炼,在工业上,用一氧化碳(CO)还原氧化铁(Fe₂O₃)来制取铁:3CO + Fe₂O₃ = 2Fe + 3CO₂,而对于一些非常活泼的金属,如钠(Na)、镁等,则需要采用电解法进行冶炼。
- 金属的防护
了解金属活动性顺序表有助于我们采取有效的措施来防护金属,对于氢前金属,如铁,在潮湿的空气中容易生锈,这是因为铁与空气中的氧气和水发生了化学反应,为了防止铁生锈,可以采取涂漆、镀锌等方法,这些方法可以在铁表面形成一层保护膜,阻止氧气和水与铁接触,而对于氢后金属,如铜,虽然其活动性较弱,但在某些特定环境下也可能发生腐蚀,同样需要采取相应的防护措施。
- 化学反应的判断
在判断某些化学反应是否能够发生时,金属活动性顺序表是一个重要的依据,判断铝(Al)能否与氯化铜溶液反应,根据金属活动性顺序表可知,铝的活动性比铜强,所以该反应能够发生,而判断银能否与氯化镁溶液反应,由于银的活动性比镁弱,所以该反应不能发生。
金属活动性顺序表中的氢前和氢后划分,是化学研究中的一个重要概念,氢前金属具有较强的活动性,能与酸发生置换反应生成氢气,还能与一些盐溶液发生置换反应;而氢后金属活动性较弱,一般不能与酸发生置换反应,但在特定条件下也能与某些盐溶液发生反应,金属活动性顺序表在金属的冶炼、防护以及化学反应的判断等方面都有着广泛的应用,通过对金属活动性顺序表的深入研究和理解,我们能够更好地探索化学世界的奥秘,为人类的生产和生活提供更多的帮助,在未来的化学研究中,金属活动性顺序表及其相关知识将继续发挥重要作用,帮助我们不断开拓新的领域,创造更多的奇迹。






 京公网安备11000000000001号
京公网安备11000000000001号 沪ICP备19017178号-1
沪ICP备19017178号-1
还没有评论,来说两句吧...