金属活动性顺序表是探索金属世界的重要密码,它按照金属在水溶液中失去电子的能力强弱进行排列,反映了金属的活泼程度,通过该顺序表,我们可以了解不同金属与酸、盐等物质反应的难易程度,以及金属间的置换规律,在实际应用中,它有助于判断金属能否发生置换反应、选择合适的金属材料、理解金属腐蚀等现象,金属活动性顺序表犹如一把钥匙,开启了深入研究金属性质和应用的大门,为化学领域的诸多研究和实践提供了关键依据。
在化学的广袤领域中,金属活动性顺序表宛如一把神奇的钥匙,开启了我们对金属世界奥秘探索的大门,它不仅仅是一系列金属元素的简单排列,更是蕴含着丰富化学知识和规律的重要工具。
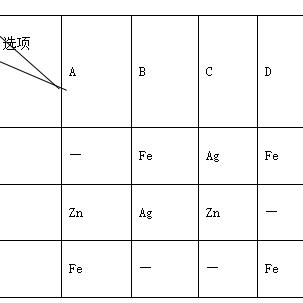
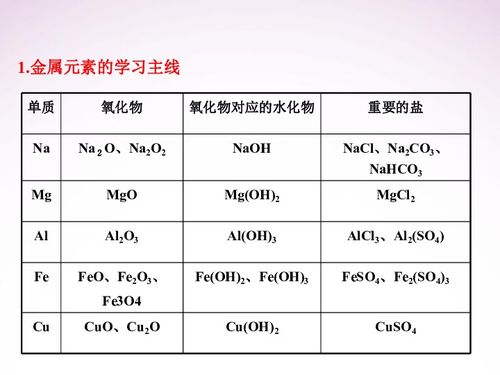
金属活动性顺序表的名称本身就具有一定的科学性和系统性,它按照金属在水溶液中失去电子的难易程度进行排列,从强到弱依次为钾(K)、钙(Ca)、钠(Na)、镁(Mg)、铝(Al)、锌(Zn)、铁(Fe)、锡(Sn)、铅(Pb)、氢(H)、铜(Cu)、汞(Hg)、银(Ag)、铂(Pt)、金(Au),这个顺序反映了金属在化学反应中的活泼性差异,对于理解金属的性质、反应以及在实际应用中都具有至关重要的意义。
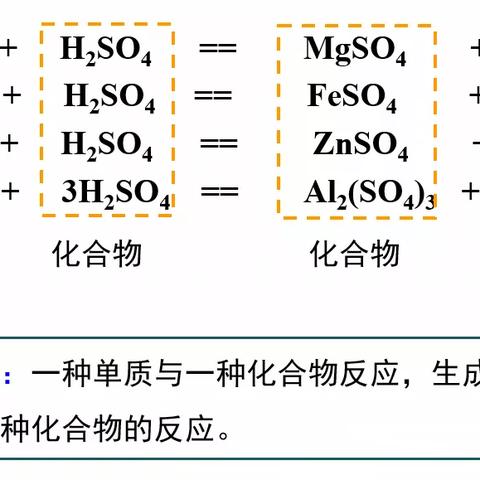
金属活动性顺序表帮助我们理解金属与酸的反应,在金属活动性顺序表中,排在氢前面的金属能够与酸发生置换反应,产生氢气,锌与盐酸反应会生成氯化锌和氢气,化学方程式为Zn + 2HCl = ZnCl₂ + H₂↑,而排在氢后面的金属,如铜,则不能与酸发生置换反应,这是因为氢原子在酸中更容易失去电子形成氢离子(H⁺),而金属原子则需要从酸中夺取氢离子,金属的活动性越强,越容易失去电子,也就越容易与酸发生反应,通过观察金属与酸的反应现象,我们可以初步判断金属在金属活动性顺序表中的位置。
金属活动性顺序表对于金属与盐溶液的反应也有着明确的指导作用,排在前面的金属能够将排在后面的金属从其盐溶液中置换出来,铁与硫酸铜溶液反应会生成硫酸亚铁和铜,化学方程式为Fe + CuSO₄ = FeSO₄ + Cu,这是因为铁的活动性比铜强,能够将铜离子从硫酸铜溶液中置换出来,这种置换反应在实际生活中有很多应用,比如湿法冶金就是利用金属活动性顺序表的原理来提取金属。
金属活动性顺序表还可以帮助我们理解金属的腐蚀现象,在潮湿的环境中,金属容易与空气中的氧气和水发生化学反应,导致金属表面生锈或腐蚀,金属的活动性越强,越容易与氧气和水发生反应,腐蚀的速度也就越快,铁在空气中容易生锈,而金则几乎不与氧气和水发生反应,具有很好的耐腐蚀性。
金属活动性顺序表的发现和应用经历了漫长的历史过程,科学家们通过大量的实验和观察,逐渐总结出了这个规律,它不仅是化学学科的重要基础,也在材料科学、冶金工业、环境保护等领域有着广泛的应用,在金属的冶炼过程中,根据金属的活动性顺序选择合适的还原剂和冶炼方法,可以提高金属的回收率和纯度;在金属的防腐处理中,也可以根据金属的活动性顺序选择合适的防护措施,延长金属制品的使用寿命。
金属活动性顺序表并不是绝对的,在某些特殊情况下,金属的活动性可能会发生变化,在高温或强氧化剂的作用下,一些原本不活泼的金属可能会变得活泼起来,金属的晶体结构、表面状态等因素也会对金属的活动性产生影响,在实际应用中,我们需要综合考虑多种因素,灵活运用金属活动性顺序表的知识。
金属活动性顺序表是化学领域中一个非常重要的工具,它帮助我们理解金属的性质、反应和应用,通过学习和掌握金属活动性顺序表,我们可以更好地探索金属世界的奥秘,为解决实际问题提供有力的支持,金属活动性顺序表也不断地在科学研究和实践中得到完善和发展,为我们打开了更加广阔的化学天地,让我们继续深入研究和探索金属活动性顺序表,发现更多的化学规律和应用,为人类的进步和发展做出更大的贡献。







 京公网安备11000000000001号
京公网安备11000000000001号 沪ICP备19017178号-1
沪ICP备19017178号-1
还没有评论,来说两句吧...