金属活动性顺序表是化学中重要的工具,它展示了金属在化学反应中的活泼程度,对于氢元素在该顺序表中的位置,一直存在着疑问。,氢通常被认为具有一定的金属性,但它并不像典型的金属那样具有良好的导电性和延展性,为什么氢会出现在金属活动性顺序表中呢?,一种观点认为,氢的位置与它在化学反应中的得失电子能力有关,氢可以失去一个电子形成氢离子(H+),表现出一定的金属性。,另一种观点则认为,氢的位置是历史和传统的结果,在早期的化学研究中,人们根据氢与其他元素的反应性质将其放置在金属活动性顺序表中。,尽管存在不同的解释,但氢在金属活动性顺序表中的位置仍然是一个有争议的话题,进一步的研究和实验可能有助于我们更好地理解氢元素的性质和在化学中的地位。
金属活动性顺序表是化学学习中的一个重要工具,它按照金属在水溶液中失去电子的能力强弱进行排列,在这个顺序表中,氢元素具有特殊的位置,处于金属与非金属的交界地带,金属活动性顺序表为什么会有氢元素呢?这是一个值得深入探讨的问题,它涉及到化学的多个方面,包括原子结构、化学键、氧化还原反应等,本文将从这些角度出发,试图揭开金属活动性顺序表中氢元素存在的神秘面纱。
氢元素的原子结构特点
(一)电子排布 氢原子的电子排布为1s1,它只有一个电子,位于第一电子层,这个电子处于能量最低的状态,因此氢原子相对比较稳定。
(二)化合价 氢原子在化学反应中可以表现出不同的化合价,当它与金属元素结合时,通常显+1价,如在HCl中;当它与非金属元素结合时,也可以显-1价,如在NaH中,这种特殊的化合价性质也与氢元素在金属活动性顺序表中的位置有关。
金属活动性顺序表的形成依据
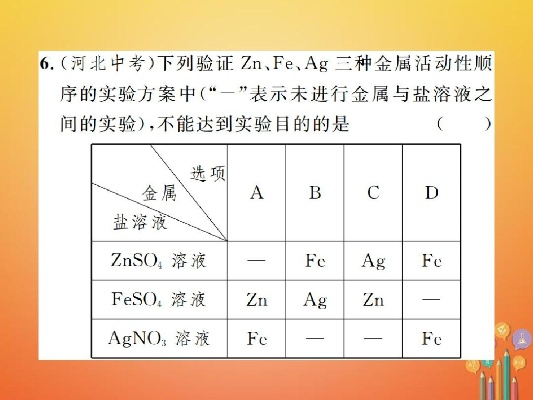
(一)与酸的反应 金属活动性顺序表是通过金属与酸的反应来确定的,金属越活泼,越容易与酸发生反应,置换出酸中的氢,镁、铝等金属可以与稀盐酸、稀硫酸等酸反应,产生氢气;而铜、银等金属则不能与酸反应,这种反应现象可以反映出金属在水溶液中失去电子的能力强弱,从而确定了金属活动性顺序。
(二)与水的反应 除了与酸的反应,金属与水的反应也可以用来判断金属的活动性,一些活泼金属,如钾、钙、钠等,可以与水剧烈反应,生成氢气和相应的碱;而一些不活泼金属,如铜、铁等,则只能在高温下与水反应,这种反应现象也与金属的原子结构和化学键有关。
(三)氧化还原反应 金属活动性顺序表还可以通过氧化还原反应来确定,在氧化还原反应中,金属原子失去电子,被氧化;而酸或水等物质中的氢原子得到电子,被还原,金属的活动性越强,越容易失去电子,被氧化;而酸或水等物质中的氢原子越容易得到电子,被还原,这种氧化还原反应的趋势也反映了金属在水溶液中失去电子的能力强弱,从而确定了金属活动性顺序。
氢元素在金属活动性顺序表中的位置
(一)位于金属与非金属的交界地带 根据金属活动性顺序表,氢元素位于金属与非金属的交界地带,这是因为氢原子的电子排布和化合价性质既具有金属的特点,又具有非金属的特点,氢原子只有一个电子,容易失去电子,表现出金属的性质;氢原子也可以得到一个电子,形成稳定的氢负离子,表现出非金属的性质,氢元素在金属活动性顺序表中的位置是合理的。
(二)与金属和非金属的反应 氢元素与金属和非金属都可以发生反应,与金属反应时,氢元素通常显+1价,表现出非金属的性质;与非金属反应时,氢元素也可以显-1价,表现出金属的性质,这种特殊的反应性质也与氢元素在金属活动性顺序表中的位置有关。
氢元素在金属活动性顺序表中的作用
(一)判断金属的活动性 金属活动性顺序表是判断金属活动性的重要依据,通过金属与酸、水的反应以及氧化还原反应等现象,可以确定金属在金属活动性顺序表中的位置,从而判断金属的活动性强弱。
(二)预测金属与酸、水的反应 金属活动性顺序表还可以预测金属与酸、水的反应,金属越活泼,越容易与酸、水发生反应,镁、铝等金属可以与稀盐酸、稀硫酸等酸反应,产生氢气;而铜、银等金属则不能与酸、水反应。
(三)指导金属的冶炼 金属活动性顺序表还可以指导金属的冶炼,金属越活泼,越难冶炼;金属越不活泼,越容易冶炼,钾、钙、钠等金属是通过电解熔融盐的方法来冶炼的;而铜、铁等金属则是通过还原氧化物的方法来冶炼的。
金属活动性顺序表中氢元素的存在是由其原子结构特点和化学反应性质决定的,氢原子的电子排布和化合价性质既具有金属的特点,又具有非金属的特点,因此它在金属活动性顺序表中处于金属与非金属的交界地带,金属活动性顺序表是判断金属活动性、预测金属与酸、水的反应以及指导金属的冶炼的重要依据,通过对金属活动性顺序表中氢元素的研究,我们可以更好地理解化学的本质和规律,为化学的发展和应用提供理论支持。






 京公网安备11000000000001号
京公网安备11000000000001号 沪ICP备19017178号-1
沪ICP备19017178号-1
还没有评论,来说两句吧...