《探秘金属活动性顺序表初中版》深入解读了这一重要化学知识,首先介绍了金属活动性顺序表的基本构成,即钾钙钠镁铝、锌铁锡铅氢、铜汞银铂金,通过生动的实验演示,如金属与酸的反应、金属间的置换反应等,让学生直观感受不同金属的活泼程度差异,同时阐述了该顺序表在判断金属能否与酸反应、金属间能否发生置换反应等方面的关键作用,还探讨了其在实际生活中的应用,如金属的冶炼、防止金属腐蚀等,帮助初中学生全面、系统地理解金属活动性顺序表的内涵与意义。
在初中化学的知识海洋中,金属活动性顺序表犹如一颗璀璨的明珠,闪耀着独特的光芒,它不仅是理解众多化学现象和反应的关键钥匙,更是开启化学奥秘之门的重要工具。
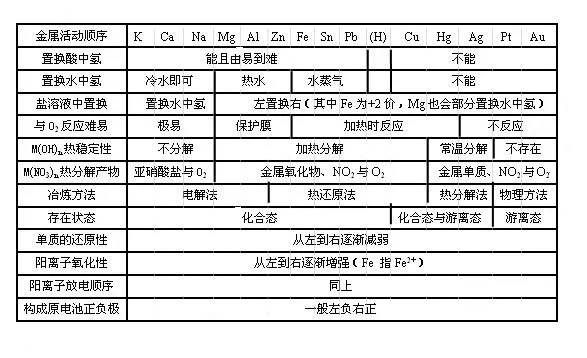
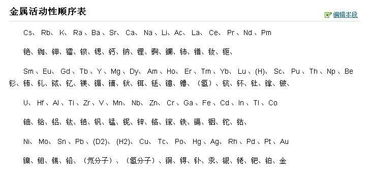
金属活动性顺序表是按照金属在水溶液中失去电子的能力由强到弱排列的,它的排列顺序为:钾(K)、钙(Ca)、钠(Na)、镁(Mg)、铝(Al)、锌(Zn)、铁(Fe)、锡(Sn)、铅(Pb)、氢(H)、铜(Cu)、汞(Hg)、银(Ag)、铂(Pt)、金(Au)。
为什么会有这样的顺序呢?这主要与金属原子的结构有关,金属原子的最外层电子数较少,容易失去电子,形成阳离子,而金属活动性的强弱就取决于金属原子失去电子的难易程度,在金属活动性顺序表中,排在前面的金属比排在后面的金属更容易失去电子,其活动性也就更强。
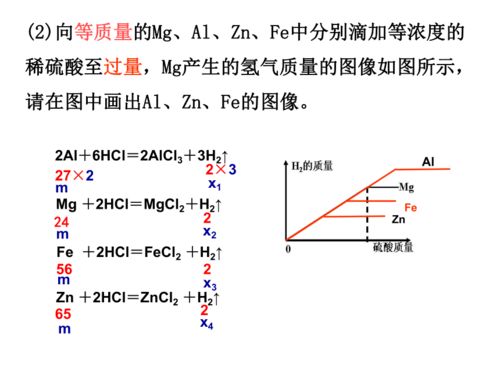
金属活动性顺序表在初中化学中有广泛的应用,它可以帮助我们判断金属与酸的反应,排在氢前面的金属能够与酸发生置换反应,生成盐和氢气;而排在氢后面的金属则不能与酸发生反应,锌可以与稀硫酸反应生成硫酸锌和氢气,而铜则不能与稀硫酸反应,这一性质在实验室制取氢气时有着重要的应用。
金属活动性顺序表还可以用来判断金属与盐溶液的反应,排在前面的金属能够把排在后面的金属从其盐溶液中置换出来,铁可以与硫酸铜溶液反应生成硫酸亚铁和铜,这一反应现象非常明显,铁表面会覆盖一层红色的铜,溶液的颜色也会由蓝色逐渐变为浅绿色,通过这个实验,我们可以直观地看到金属活动性顺序表的应用。
金属活动性顺序表对于理解金属的冶炼过程也有着重要的意义,金属的冶炼是将金属从其化合物中还原出来的过程,根据金属活动性顺序表,我们可以选择合适的还原剂来冶炼不同的金属,对于比较活泼的金属,如铝、镁等,可以用电解法进行冶炼;对于比较不活泼的金属,如汞、银等,可以通过加热其氧化物的方法进行冶炼。
在学习金属活动性顺序表的过程中,我们还需要注意一些问题,金属活动性顺序表是在水溶液中得出的结论,对于非水溶液中的反应可能不适用,金属活动性顺序表只是一个相对的顺序,并不是绝对的,在某些特殊情况下,可能会出现不符合顺序表的现象,在高温下,铜可以与氢气发生反应,生成氧化铜和水。
金属活动性顺序表是初中化学中非常重要的知识点,它不仅是理解化学现象和反应的关键,也是我们进行化学实验和生产实践的重要依据,通过学习金属活动性顺序表,我们可以更好地理解金属的性质和用途,培养我们的科学思维和实验能力,让我们一起深入探索金属活动性顺序表的奥秘,开启化学学习的新篇章!












 京公网安备11000000000001号
京公网安备11000000000001号 沪ICP备19017178号-1
沪ICP备19017178号-1
还没有评论,来说两句吧...