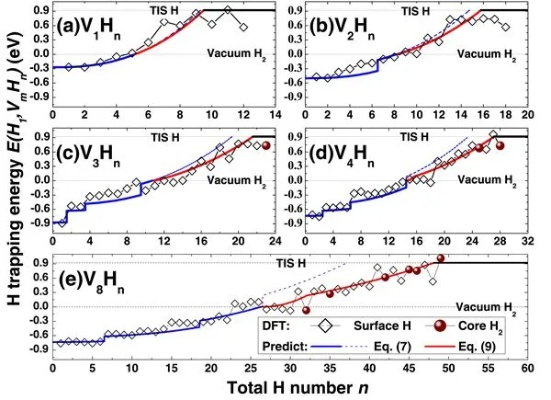
金属氢化物的稳定性是一个重要的物理性质,它对于理解金属氢化物的性质和应用具有重要意义,金属氢化物的稳定性可以通过多种方法来判断,例如通过热力学方法、动力学方法和结构化学方法等,热力学方法是最常用的方法之一,它通过计算金属氢化物的生成自由能来判断其稳定性,动力学方法则是通过研究金属氢化物的分解反应速率来判断其稳定性,结构化学方法则是通过研究金属氢化物的晶体结构和化学键来判断其稳定性,判断金属氢化物的稳定性需要综合考虑多种因素,并且需要使用多种方法来进行研究。
** 金属氢化物在众多领域都有重要应用,而其稳定性是一个关键特性,本文详细探讨了判断金属氢化物稳定性的多种方法,包括元素周期表规律、金属原子半径与离子半径、化学键类型与键能、氧化态等方面,通过对这些因素的分析,旨在帮助读者深入理解金属氢化物稳定性的判断依据,为相关研究和应用提供理论支持。
金属氢化物是一类由金属元素与氢元素组成的化合物,它们具有独特的物理和化学性质,在能源存储、催化、材料科学等领域有着广泛的应用前景,金属氢化物的稳定性直接影响其在这些领域的性能和应用效果,准确判断金属氢化物的稳定性对于相关研究和实际应用具有重要意义。
金属氢化物稳定性的影响因素
(一)元素周期表规律
- 同周期元素 在同一周期中,从左到右,金属元素的原子半径逐渐减小,金属性逐渐减弱,对于金属氢化物,原子半径越小,与氢原子之间的化学键越强,金属氢化物越稳定,在第三周期中,钠(Na)的原子半径较大,形成的氢化钠(NaH)相对不稳定;而镁(Mg)的原子半径较小,氢化镁(MgH₂)的稳定性则相对较好。
- 同族元素 同族元素的原子半径随着原子序数的增加而增大,金属性逐渐增强,同族元素的金属氢化物稳定性从上到下逐渐减弱,碱金属元素(Li、Na、K、Rb、Cs)从上到下,原子半径依次增大,金属性依次增强,它们的氢化物稳定性也依次降低,氢化锂(LiH)最稳定,而铯化氢(CsH)最不稳定。
(二)金属原子半径与离子半径
- 金属原子半径 金属原子半径越大,其对外层电子的束缚力越弱,与氢原子形成化学键时,电子云的重叠程度越小,化学键越弱,金属氢化物越不稳定,在碱土金属元素中,铍(Be)的原子半径较小,形成的氢化铍(BeH₂)相对稳定;而钡(Ba)的原子半径较大,氢化钡(BaH₂)的稳定性则较差。
- 金属离子半径 当金属原子失去电子形成离子时,离子半径会发生变化,对于金属氢化物,金属离子半径越小,与氢离子之间的静电吸引力越强,金属氢化物越稳定,在过渡金属元素中,二价离子半径较小的铁(Fe²⁺)形成的氢化亚铁(FeH₂)比二价离子半径较大的锌(Zn²⁺)形成的氢化锌(ZnH₂)更稳定。
(三)化学键类型与键能
- 化学键类型 金属氢化物中的化学键类型主要有离子键、共价键和金属键,离子键型的金属氢化物稳定性较强,共价键型的金属氢化物稳定性较弱,金属键型的金属氢化物稳定性最差,氢化钠(NaH)是典型的离子键型金属氢化物,稳定性较好;而氢化铝(AlH₃)则具有一定的共价键成分,稳定性相对较差。
- 键能 键能是衡量化学键强弱的重要参数,金属氢化物中金属与氢之间的键能越大,金属氢化物越稳定,键能的大小与原子的电负性、原子半径等因素有关,在第IA族金属氢化物中,锂化氢(LiH)的键能最大,稳定性最好;而铯化氢(CsH)的键能最小,稳定性最差。
(四)氧化态 金属氢化物中金属元素的氧化态也会影响其稳定性,金属元素的氧化态越高,其与氢原子之间的化学键越强,金属氢化物越稳定,在金属氢化物中,金属元素的氧化态为+1的氢化锂(LiH)比氧化态为+2的氢化镁(MgH₂)更稳定。
判断金属氢化物稳定性的方法
(一)理论计算 通过量子化学计算等理论方法,可以计算金属氢化物的晶体结构、化学键参数、能量等信息,从而预测其稳定性,理论计算方法可以考虑多种因素的影响,能够较为准确地预测金属氢化物的稳定性,但计算成本较高,需要较高的专业知识和计算能力。 (二)实验研究 通过实验测定金属氢化物的生成焓、分解温度、分解压力等参数,可以直观地判断其稳定性,实验研究方法具有直观、准确等优点,但实验条件较为复杂,需要耗费大量的时间和精力。 (三)比较相似化合物的稳定性 对于结构相似的金属氢化物,可以通过比较它们的结构、化学键类型、键能等因素,来判断其稳定性,对于碱金属氢化物,可以通过比较它们的原子半径、离子半径、氧化态等因素,来判断其稳定性。
金属氢化物的稳定性是一个复杂的问题,受到多种因素的影响,通过对元素周期表规律、金属原子半径与离子半径、化学键类型与键能、氧化态等因素的分析,我们可以初步判断金属氢化物的稳定性,在实际应用中,我们可以结合理论计算、实验研究等方法,更加准确地判断金属氢化物的稳定性,随着科学技术的不断发展,对于金属氢化物稳定性的研究也将不断深入,为其在能源存储、催化、材料科学等领域的应用提供更加坚实的理论基础。





 京公网安备11000000000001号
京公网安备11000000000001号 沪ICP备19017178号-1
沪ICP备19017178号-1
还没有评论,来说两句吧...